Visuelle
Informationsverarbeitung im Gehirn
Karl R. Gegenfurtner,
Sebastian Walter und Doris I. Braun
Abteilung
Allgemeine Psychologie,
Justus-Liebig-Universität
Otto-Behaghel-Str. 10F, 35394 Gießen
Tel.:
0641/9926100
Fax:
0641/9926119
Email:
gegenfurtner@uni-giessen.de
Publiziert als: Gegenfurtner, K.R., Walter, S. & Braun, D.I. (2002) Visuelle Informationsverarbeitung im Gehirn In: Bild | Medien | Wissen. Visuelle Kompetenz im medienzeitalter (Eds. Huber, H.D., Lockermann, B. & Scheibel, M.) Kopaed Verlag, München.
Überblick
Die besondere
Bedeutung der visuellen Wahrnehmung für Menschen und andere Primaten
kann man
an der Größe und der Anzahl der an der Bildanalyse beteiligten
Gehirnareale
ablesen. Neben der primären Sehrinde (V1), die etwa 15% der gesamten
Großhirnrinde ausmacht, wurden bisher mehr als 30 verschiedene visuelle
Areale
beschrieben. Insgesamt sind etwa 60% der Großhirnrinde an der
Wahrnehmung,
Interpretation und Reaktion auf visuelle Reize beteiligt.
Analysiert man
die Informationsverarbeitung des visuellen Systems auf der Ebene
einzelner
Neurone, stellt man fest, dass die Eingangsrezeptoren in der Netzhaut
(Retina)
des Auges die im visuellen Reiz enthaltene Information zerlegen,
abstrahieren
und in geordneter Form an die nächste Verarbeitungsstufe weiterleiten.
Von der
primären Sehrinde im Hinterhauptslappen (Okzipitalkortex)
ausgehend scheint die kortikale Verarbeitung visueller Information über
zwei
Hauptpfade zu verlaufen, einem dorsalen parietalen
Pfad, der zum Scheitellappen (Parietalkortex)
verläuft und einem ventralen temporalen Pfad, der zum unteren
Schläfenlappen
(Temporalkortex) zieht (siehe Abb. 1). Während der parietale
Verarbeitungsstrom der Steuerung von Handlungen bzw. der Bewegungs- und
Positionswahrnehmung (daher auch „Wo-Strom“ genannt) dient, ist der
temporale
Strom für das Erkennen von Objekten bzw. für die Farb-, Muster-und
Formwahrnehmung (daher auch„Was-Strom“ genannt) von besonderer
Bedeutung (Goodale & Milner, 1992;
Ungerleider & Mishkin, 1982). Die
Grundlage für
die funktionelle Unterteilung des visuellen Kortex in zwei
Hauptverarbeitungsströme bilden psychophysische und klinische
Untersuchungen an
Menschen und physiologische (Einzelzellableitungen und Läsionsstudien)
und anatomische Experimente an Affen.
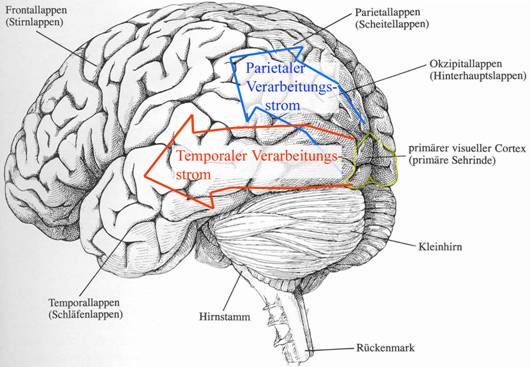
Abb. 1: Das menschliche Gehirn von der Seite betrachtet. Ausgehend von der primären Sehrinde (gelb umrandet) werden bei der kortikalen Informationverarbeitung zwei Hauptströme unterschiedlicher Funktion unterschieden: ein temporaler Verarbeitungsstrom (rot), welcher zum Schläfenlappen zieht und wichtig für die Objekterkennung ist und ein parietaler Verarbeitungsstrom (blau), welcher zum Scheitel- oder Parietallappen zieht und für die Objektlokalisation und Bewegungswahrnehmung wichtig ist.
Gegenwärtig ist
nur unser Wissen über die ersten Stufen der visuellen Verarbeitung
ausgehend
von der Retina bis zur primären Sehrinde, V1, relativ groß. So wissen
wir zum
Beispiel wie die visuelle Information in V1 verteilt wird und welche
Eigenschaften die Neurone in den einzelnen Schichten von V1 besitzen.
Von den
sich anschließenden höheren sekundären und tertiären
Verarbeitungsebenen ist
zwar bekannt, auf welche visuellen Reize, wie zum Beispiel Hände,
Gesichter
oder Bewegungsmuster, einzelne Neurone maximal antworten, aber wie es
zu dieser
erstaunlichen Selektivität kommt, ist weitgehend unklar. Im Folgenden
sollen
zunächst die ersten Stufen der Bildanalyse dargestellt werden.
Drei Prinzipien
der visuellen Informationsverarbeitung sind besonders hervorzuheben: 1.
Die retinotope Organisation: Das visuelle
System zeichnet sich
bei der Repräsentation des Gesichtsfeldes durch eine große räumliche
Ordnung
aus. Diese Ordnung kann von den Eingangsrezeptoren im Auge bis in die
höheren
Ebenen im Gehirn verfolgt werden, auch wenn durch die Konvergenz der
Eingangssignale die Kartierung des visuellen Raumes immer gröber wird.
2. Die
Modularität: Neurone, die für bestimmte Eigenschaften visueller Reize
empfindlich
sind, bilden funktionale Netzwerke oder Säulensysteme. Diese einzelnen
Netzwerke bzw. Säulensysteme unterscheiden sich von anderen durch ihre
Eingangssignale, ihr Antwortverhalten und ihre Verschaltungen. 3.
Spezialisierung: Entlang der Verarbeitungsbahnen nimmt die
Spezialisierung auf
bestimmte Aspekte der Bildanalyse, d. h. die Komplexität der visuellen
Reize,
die eine maximale neuronale Antwort hervorrufen können, zu. Während
Neurone der
primären Sehrinde kleine Liniensegmente einer bestimmten Orientierung
an einem
bestimmten Ort im Gesichtsfeld als Reiz bevorzugen, antworten bestimmte
Neurone
im unteren Temporallappen nur auf Gesichter, und zwar relativ
unabhängig von
ihrer Position. In den höheren Verarbeitungsebenen wird das
Antwortverhalten
auf einen Reiz auch durch andere Faktoren wie Aufmerksamkeit,
Gedächtnis oder
mit dem Reiz verbundene Handlungen beeinflusst.
Die Landkarte im Auge - Retinotopie
In der Retina
wird eine Ganglienzelle immer von denselben Photorezeptoren erregt, die
auf
Reize in einem bestimmten Bereich des visuellen Feldes reagieren.
Dieser
Bereich des Gesichtfeldes, in dem visuelle Reize eine neuronale Antwort
hervorrufen, lässt sich relativ genau bestimmen oder kartieren und wird
als das
rezeptive Feld des Neurons bezeichnet. Nebeneinander liegende retinale Ganglienzellen besitzen benachbarte und
auch
überlappende rezeptive Felder und projizieren zu benachbarten Neuronen
der
nächst höheren Stufe. Diese räumliche
Ordnung bleibt
von der Rezeptorebene in der Retina bis in die höheren
Verarbeitungsebenen im
Kortex (neuronale topographische Karten) weitgehend erhalten, auch wenn
die
rezeptiven Felder von Stufe zu Stufe zunehmend größer werden.
Fast alle (90%) der retinalen Ganglienzellen projizieren zum im Thalamus liegenden seitlichen Kniehöcker, dem Corpus geniculatum laterale (Genikulatum), der wichtigsten subkortikale Schaltstation zwischen Retina und Kortex. Das Geniculatum besteht aus sechs übereinanderliegenden Zellkörperschichten, zwei Schichten (Schicht 1 & 2) mit relativ großen (magno-) Neuronen und 4 Schichten (Schicht 3-6) mit kleinen (parvo-) Neuronen. Durch die Überkreuzung der Retinafasern der nasalen Retinahälften erhält jedes Geniculatum seine Eingänge von den Ganglienzellen, die auf Reize in der gegenüberliegenden Gesichtsfeldhälfte antworten (siehe Abb. 2). So erhält beispielsweise das linke Geniculatum seine Eingänge aus der linken Retinahälfte jedes Auges, die temporale Hälfte des linken ipsilateralen Auges und die nasale Hälfte des rechten kontralateralen Auges. Im Geniculatum kommt es aber zu keiner Vermischung der Ganglienfasern, denn jede Schicht erhält ihre Eingangssignale nur von einem Auge. Die Fasern der nasalen Retinahälfte des jeweils gegenüber liegenden (kontralateralen) Auges enden in den Schichten 1, 4 und 6, die der temporalen Retinahälfte des ipsilateralen Auges enden in den Schichten 2, 3 und 5. Die Information beider Augen wird erst später in V1 zusammengeschaltet. Durch den Erhalt der räumlichen Anordnung der retinalen Ganglienzellen bei der Projektion sind auch die Geniculatumschichten retinotop organisiert. Die sechs Schichten sind also so angeordnet, dass die sechs neuronalen Karten der kontralateralen Gesichtsfeldhälfte genau übereinanderliegen, und sich daher auch die Zentren der rezeptiven Felder von vertikal übereinander liegenden Neuronen aller Schichten an derselben Stelle befinden. Das Geniculatum dient nicht nur als Durchgangsstation für die Eingangssignale vom Auge zum primären visuellen Kortex, sondern es erhält auch zahlreiche Eingänge aus dem Kortex oder vom Hirnstamm. Vermutlich kann der retinale Informationsstrom in Geniculatum reguliert werden, indem beispielsweise ein bestimmter Reiz über Feedbackverbindungen verstärkt wird.
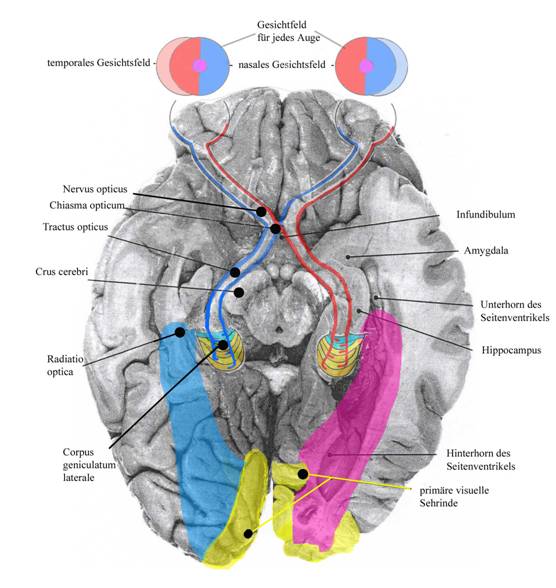
Abb.2: Schematische und anatomische Ansicht von unten auf das menschliche visuelle System. Auf der rechten Seite ist ein Horizontalschnitt gezeigt, welcher durch den Seitenventrikel verläuft. Die Farben der Retinahälften und der Gesichtsfeldhälften repräsentieren die Projektion. Licht aus dem Zentrum des Gesichtsfeldes (lila) fällt auf die Fovea, der dunkelrot und dunkelblau eingezeichnete Bereich des Gesichtsfeldes wird binokular abgebildet. Die Axone der über 1 Mill. Ganglienzellen jedes Auges bilden den Sehnerv (Nervus opticus). Die Nervenfasern der nasalen Retinahälfte beider Augen ziehen zur gegenüberliegenden Hirnhälfte und kreuzen sich im sogenannten Chiasma opticum, während die Fasern der temporalen Retinahälften ungekreuzt bleiben. Über 90% der Sehnervenfasern ziehen zu den sechs verschiedenen Schichten des Corpus geniculatum laterale und von dort als Sehstrahlung (Radiatio optica) in den primären visuellen Kortex. Durch das Chiasma gelangen die Signale des linken (bzw. rechten) Gesichtsfeldes (in rot eingezeichnet) in die rechte (bzw. linke) Hirnhälfte.
Funktionale Netzwerke und Säulensysteme -Modularität
Retinale
Ganglienzellen besitzen kleine kreisförmige rezeptive Felder, die eine
antagonistisch verschaltete Zentrum-Umfeld-Organisation
aufweisen. Man unterscheidet zwei Typen: Etwa die Hälfte der
Ganglienzellen
sind On-Zentrum-Ganglienzellen, die durch
einen auf
ihr Zentrum fallenden Lichtreiz erregt und durch Beleuchtung ihres
ringförmigen
Umfelds gehemmt werden. Die andere Hälfte sind Off-Zentrum-Ganglienzellen,
welche durch einen zentralen Lichtreiz gehemmt und eine reine
Umfeldbeleuchtung
erregt werden. Wird hingegen das gesamte rezeptive Feld beider
Ganglienzelltypen gleichmäßig beleuchtet, antworten sie nur schwach. In
der Fovea, der Stelle schärfsten Sehens,
beträgt der
Durchmesser der Feldzentren nur einige Bogenminuten, in der Peripherie
dagegen
bis zu 3-5 Grad. Die antagonistische Verschaltung zwischen einem
erregenden
Zentrum und einem hemmenden Umfeld bedingt die hohe Empfindlichkeit der
Ganglienzellen für örtliche Kontrastveränderungen. Werden
Ganglienzellen zum
Beispiel schwarz-weiße Muster dargeboten, führt die gleichzeitige
Hemmung und
Erregung von Zentrum und Umfeld entlang der kontrastreichen
Musterkanten zu
Zellantworten, die zu einer Verstärkung der Helligkeitsunterschiede
(Mach-Bänder) und auch Täuschungen (Hermanngitter) in der Wahrnehmung
führen
können. Dies wird in Abb. 3 verdeutlicht.
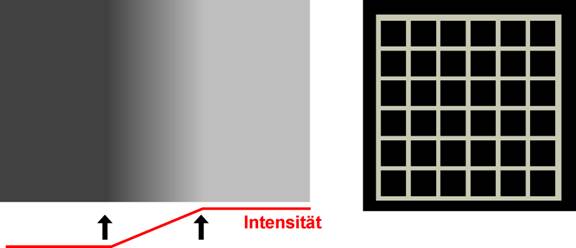
Abb. 3: Mach-Bänder und Hermann-Gitter. In der linken Abbildung wird ein rampenförmiger Intensitätsverlauf dargestellt. An den Enden der Rampe kommt es zur Wahrnehmung von dunklen und hellen Bändern, die im physikalischen Reiz nicht vorhanden sind. Rechts ist ein gleichförmig graues Gitter dargestellt. Die Kreuzungspunkte werden deutlich dunkler wahrgenommen. Beide Phänomene lassen sich durch wechselseitige Hemmprozesse in retinalen Ganglienzellen erklären.
Neben den
parallel verlaufenden On- und Off-Zentrumsbahnen gibt es noch weitere
funktionale Unterteilungen bei der visuellen Informationsverarbeitung.
In der
Retina existieren 12-15 verschiedene Typen von Ganglienzellen, die sich
äußerlich beispielsweise durch ihre Größe und die Verzweigungsmuster
ihrer
Fortsätze (Dendriten) unterscheiden
lassen. Die wichtigsten Ganglienzelltypen sind kleine, sogenannte parvozelluläre oder P-Zellen (auch Zwergzellen)
und große,
sogenannte magnozelluläre oder M-Zellen
(auch
Schirmzellen). Die P-Zellen besitzen eine hohe räumliche Dichte und kleine
Dendritenbäume. Daher ermöglichen sie ein hohes
Auflösungsvermögen (Sehschärfe). Bei Primaten sind
P-Zellen farbempfindlich, da die Eingangssignale der drei für
unterschiedliche
Wellenlängenbereiche empfindlichen Photorezeptoren, den Zapfen,
getrennt
verarbeitet werden. In der Retina
werden aus den Signalen der drei Zapfen drei Gegenfarbsignale, welche
den
sogenannten rot-grünen, blau-gelben, und schwarz-weißen Farbmechanismus
bilden.
Auch hier antworten Zentrum und ringförmiges Umfeld der rezeptiven
Felder in
antagonistischer Weise: Ist zum Beispiel eine Ganglienzelle besonders
durch
zentral dargebotenes langwelliges („rotes“) Licht erregbar, wird sie
durch
zentrales mittelwelliges („grünes“) Licht gehemmt. Bei Beleuchtung des
Umfeldes
reagiert die Zelle positiv auf die Gegenfarbe des Zentrums (Grün) und
negativ
auf die Zentrumsfarbe (Rot). Die Gegenfarbsignale werden anschließend
mehr oder
weniger unverändert zum Geniculatum
weitergeleitet.
Die genauen Verschaltungen der retinalen
Neurone, die
der Kodierung spektraler Information in Gegenfarben zugrunde liegen,
wird noch
erforscht (Wässle & Boycott,
1991), während die neuronalen Signale vom Geniculatum
zu V1 genauestens bekannt sind (Derrington,
Krauskopf
& Lennie, 1984). Die Farben, die diese
Neurone im
Geniculatum jeweils optimal stimulieren,
werden
oftmals auch als „kardinale“ Farben bezeichnet.
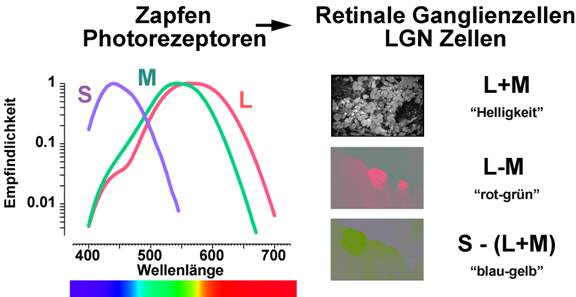
Abb. 4: Transformation der Zapfensignale in Gegenfarbkoordinaten. Links sind die Absorptionsspektren der drei Zapfentypen dargestellt, rechts daneben die Erscheinungsweise von “kardinalen” Reizen, die jeweils nur einen der anschliessenden Gegenfarbmechanismen stimulieren.
Im Gegensatz zu den
P-Zellen zeigen die M-Zellen keine Farbempfindlichkeit, da bei ihnen
die
Eingangssignale der Zapfen nicht voneinander getrennt werden. M-Zellen
weisen
eine größere Lichtempfindlichkeit und durch weit verzweigte
Dendritenbäume auch
größere rezeptiven Felder auf. Anders als P-Zellen, die während der
gesamten
Reizdauer erregt bleiben, signalisieren M-Zellen nur kurzfristige
Veränderungen
eines Lichtreizes und antworten daher nicht auf Dauerbeleuchtung.
In Abhängigkeit
des Auges (siehe oben) und des Ganglienzelltyps projizieren die
Ganglienzellfasern in eine der sechs Zellkörperschichten des Geniculatums: P-Ganglienzellen sind mit den
Neuronen der parvozellulären Schichten
(Schicht 3-6) verbunden und
M-Ganglienzellen mit den magnozellulären
Neuronen der
beiden ersten Schichten (Schicht 1 & 2). Da die Eingangssignale der
Geniculatumneurone jeweils von nur wenigen
Ganglienzellen
stammen und die Information nur geringfügig verändert wird, ähnelt ihr
Antwortverhalten dem der Ganglienzellen. So weisen die Neurone im Geniculatum ebenfalls kreissymmetrische
rezeptive Felder
mit einer antagonistischen Zentrum-Umfeld-Organisation
und eine Dichotomie von On- und Off-Zentrum-Zellen
auf.
Die Funktionen
der Magno- und Parvo-Schichten
des Geniculatums werden deutlich, wenn man
das
Verhalten von Affen nach einer gezielten Schädigung der Magno-
bzw. Parvo-Schichten untersucht (Schiller,
Logothetis & Charles, 1990). Nach einer
Magnoschichtzerstörung zeigten Affen
deutliche
Einschränkungen des Bewegungssehens, während Affen nach Parvoschichtläsionen
eine gestörte Farb-, Struktur-, und Tiefenwahrnehmung zeigten.
Die 1,5 Mill. Axone der Geniculatumneurone
projizieren als Sehstrahlung in unterschiedliche Bereiche der
Eingangsschicht
des primären visuellen Kortex. Während die Projektionen der Magnoschichten
vermutlich vor allem zum dorsalen kortikalen „Wo-Pfad“ beitragen,
bilden die
Projektionen des Parvoschichten die
Grundlage des
ventralen kortikalen „Was-Pfades“. Die Interaktion beider Systeme bei
der
kortikalen Informationsverarbeitung ist hierbei aber eher die Regel als
die
Ausnahme.
Die Betonung auf die Fovea
- Foveasierung
Fixieren wir ein
Objekt, so wird es im Zentrum der Retina, in der Fovea
centralis abgebildet. Die Fovea
nimmt circa 2 Grad des Gesichtsfelds ein. In der Fovea
ist die Sehschärfe am größten, da in diesem Netzhautbereich die Dichte
der
Photorezeptoren am größten ist. Nur hier ist höchstauflösendes
Detailsehen, wie
es zum Beispiel zum Lesen dieses Textes nötig ist, möglich. So gibt es
in der Fovea etwa 50 000 Ganglienzellen
pro Quadratmillimeter und
nur 1000 in der Peripherie. Außerdem ist hier, im Unterschied zu den
übrigen
Netzhautbereichen, eine 1:1 Verschaltung von Photorezeptoren und
Ganglienzellen
realisiert. Da nur wenige Ganglienzellen auf ein Neuron im Geniculatum
projizieren, wird die Fovea, die nur 0,01
Prozent der
gesamten Netzhaut einnimmt, und ihre direkte Umgebung durch etwa die
Hälfte der
Neuronenmasse im Geniculatum
repräsentiert. Auch im
primären visuellen Kortex bleibt dieses Verhältnis bestehen: So
repräsentieren
die Hälfte der Neuronen in V1 die Fovea
und direkt
angrenzende Regionen. Neuere Untersuchungen legen nahe, dass die
vergrößerte
Repräsentation der Fovea im Kortex nicht
nur durch
die hohe foveale Ganglienzelldichte pro
Flächeneinheit bedingt ist, sondern dass dem fovealen
Input zusätzlicher Raum zugewiesen wird. So beansprucht eine
Ganglienzelle nahe
der Fovea 3-6 mal
soviel
Kortexgewebe wie eine Ganglienzelle der Netzhautperipherie. Das Maximum
der zur
Verfügung stehenden Verarbeitungskapazität wird auf den relativ kleinen
Ausschnitt in der Mitte des Gesichtsfelds konzentriert. So ist
trotz begrenzter Ressourcen einerseits ein großes Gesichtsfeld
(horizontal ca.
180°) und andererseits ein präzises Erkennen von Details möglich.
![]()
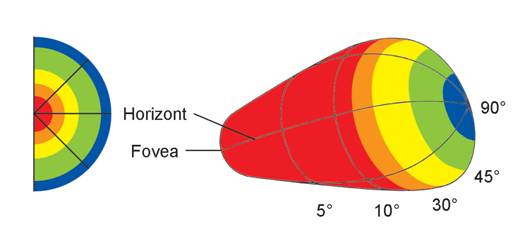
Abb. 5: Foveale Repräsentation im visuellen Kortex. Obwohl die Fovea im Gesichtsfeld (links) nur einen kleinen Bereich von ca. 2 Grad einnimmt, beansprucht sie einen großen Teil der Neurone im Kortex(rechts).
Der primäre visuelle Kortex – V1
1959 untersuchten
David Hubel und Torsten Wiesel, die 1981 für ihre Arbeit den Nobelpreis
erhielten, das Antwortverhalten von Neuronen in V1 auf visuelle Reize
(Hubel
& Wiesel, 1959). Anders als die Neurone in der Retina oder im Geniculatum, antworteten V1-Neurone nur schwach
oder gar
nicht auf punktförmige Lichtreize, aber sehr heftig auf kurze
Lichtstreifen. Je
nach Art des visuellen Reizes, der die größte Antwort hervorrief,
unterschieden
sie 3 Neuronentypen: 1. Einfache Zellen antworten auf Lichtstreifen
oder Balken
einer bestimmten Orientierung. Die länglichen rezeptiven Felder der
einfachen
Kortexzellen sind ebenfalls in eine erregende und eine hemmende Zone
unterteilt, welche aber nebeneinander liegen und in einer bestimmten
Richtung
orientiert sind (Abb. 6). Entsprechend erfolgt die stärkste Antwort,
wenn ein
streifenförmiger Reiz in derselben Orientierung und Breite wie die
erregende
Zone der Zelle dargeboten wird. Die selektive Empfindlichkeit
für die
Orientierung eines Reizes ergibt sich aus einem Vergleich der Antworten
der
Zelle bei unterschiedlichen Orientierungen des Reizes
(Orientierungs-Tuningkurve). 2.
Komplexe Zellen zeigen in ihren rezeptiven Feldern keine deutliche
Unterteilung
in erregende und hemmende Bereiche. Sie antworten ebenfalls
selektiv auf
die Orientierung streifenförmiger Reize, wobei aber die genaue Position
des
Reizes innerhalb des rezeptiven Feldes keine Rolle spielt. Sie
zeigen darüber hinaus eine Bevorzugung einer bestimmten
Bewegungsrichtung.
3. Endinhibierte,
oder hyperkomplexe Zellen antworten auf Streifen, Ecken oder Winkel
einer
bestimmten Länge, die sich in einer bestimmten Richtung über ihr
rezeptives
Feld bewegen.
Während Zellen in
der Eingangsschicht (der Schicht 4C) von V1 konzentrische rezeptive
Felder
besitzen, weisen die einfachen Zellen direkt über und unter der Schicht
4C
längliche rezeptive Felder mit Orientierungsachsen auf. Nach Hubel und
Wiesel
(1962) entstehen diese länglichen erregenden und hemmenden Zonen der
rezeptiven
Felder einfacher Zellen durch die Konvergenz von mehreren konzentrisch
organisierten Zellen (siehe Abb. 6). Auch die Eigenschaften der
rezeptiven
Felder komplexer Zellen lassen sich durch konvergente erregende
Eingänge
einfacher Zellen mit gleich aufgebauten rezeptiven Feldern erklären.
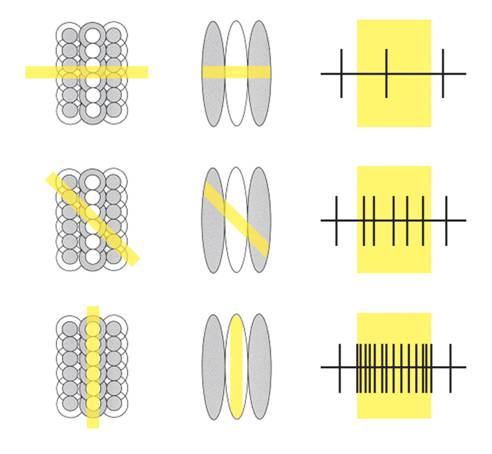
Abb. 6: Orientierungsempfindlichkeit von Neuronen in V1. In der Mitte das rezeptive Feld des Neurons. Links ist dargestellt, wie sich das rezeptive Feld aus einfacheren rezeptiven Feldern zusammensetzt. Rechts ist die Antwort der Zelle auf visuelle Reize unterschiedlicher Orientierung dargestellt. Jeder vertikale Strich entspricht einem Aktionspotential. Das Neuron reagiert am besten auf vertikale Balken.
Mit Hilfe von
senkrecht in den Kortex eingeführten Mikroelektroden wurde
festgestellt, dass
die Zentren der rezeptiven Felder von übereinander liegenden Neuronen
sich an
derselben Position im Gesichtsfeld befinden und dass diese Neurone auch
dieselbe Reizorientierung bevorzugten. Untersucht man die
Orientierungspräferenz der Neurone tangential zur Kortexoberfläche,
ändert sich
die bevorzugte Reizorientierung in kontinuierlichen Schritten. Jede
Orientierungssäule ist etwa 30-100 mm breit.

Abb. 7: Orientierungsempfindlichkeit in V1. Neurone mit ähnlichen Orientierungspräferenzen liegen in V1 nahe beisammen. Die Farben kodieren unterschiedliche bevorzugte Orientierungen. Diese sind wie in einem Windrad angeordnet und ziehen sich durch alle Schichten von V1, mit Ausnahme von Schicht IVC, in der die Signale aus dem Geniculatum ankommen.
Mit Hilfe eines
optischen bildgebenden Verfahrens, bei dem ein direktes Abbild der
Aktivität
der Neurone an der Kortexoberfläche erstellt wird (Bonhoeffer & Grinvald, 1991), konnte für V1 eine regelmäßige
windmühlenartige Anordnung der Orientierungssäulen um ein in der Mitte
liegendes Zentrum nachgewiesen werden. In jedem Windrad („pinwheel“)
kommt jede Orientierungssäule nur einmal vor. Neben den
Orientierungssäulen
wurden auch noch sogenannte Augendominanzsäulen festgestellt. So zeigen etwa die Hälfte der Neurone einer
Positionssäule bei
der Reizdarbietung eine deutliche Präferenz für das linke oder rechte
Auge.
Der visuelle
Kortex scheint also aus Säulensystemen zu bestehen, welche durch
folgende drei
Merkmale bestimmt sind: 1. Nach der Position des rezeptiven Feldes.
Alle
Neurone einer etwa 1 Quadratmillimeter großen Positionssäule erhalten
ihren
Input von derselben Retinastelle. 2. Nach der Augendominanz. Innerhalb
einer
Positionssäule gibt es für jedes Auge eine Augendominanzsäule. Die
Säulen des
rechten und linken Auges alternieren regelmäßig entlang der
Positionssäulen. 3.
Nach der Orientierung. Jede Augendominanzsäule enthält einen
vollständigen Satz
von Orientierungssäulen, deren Neurone auf das gesamte
Orientierungsspektrum
von 360 Grad reagieren. Eine Positionssäule bestehend aus den zwei
Augendominanzsäulen
und zahlreichen Orientierungssäulen wird auch als Hyperkolumne
bezeichnet. Die
Oberfläche des primären visuellen Kortex besteht also aus regelmäßig
angeordneten Hyperkolumnen, die als elementare Verarbeitungsmodule zur
Analyse
der Orientierung und Länge von Linien- und Kantensegmenten eines
bestimmten
Retinabereiches die notwendige Voraussetzung zur Formanalyse darstellen.
Verarbeitung von Farbe &
Form
Wenig Konsensus
herrscht derzeit über die kortikale Verarbeitung der Farbinformation.
Lange
Zeit war besonders die Theorie der parallelen kortikalen Verarbeitung
populär,
nach der die Farbinformation getrennt von anderen visuellen
Reizattributen wie
Form oder Bewegung verarbeitet wird. Anatomisch und physiologisch ist
laut
dieser Theorie die Repräsentation der Farbinformation in V1 auf
fleckenartige
Bereiche in den obersten Schichten der primären Sehrinde, die
sogenannten „Blobs” beschränkt, während
Form- und Bewegungsinformationen
außerhalb der „Blobs“ in den sogenannten „Interblobs“ bzw. in tieferen Schichten von V1
repräsentiert
sind.
In den „Blobs” überwiegen Neurone mit konzentrisch
organisierten
rezeptiven Feldern, welche nicht selektiv auf die Orientierung oder
Bewegungsrichtung visueller Reize reagieren aber deutliche
Farbpräferenzen aufweisen
(Livingstone & Hubel, 1984). Nach der
überwiegenden Farbpräferenz der in den Blobs
enthaltenen Neurone werden diese in „blau-gelbe“ und „rot-grüne“
unterteilt.
Darüber hinaus gibt es in V1 (anders als im Geniculatum)
auch Neurone, die nicht Farben um die zwei kardinalen Farbrichtungen
bevorzugen, sondern besonders auf bestimmte „Mischfarben“ wie zum
Beispiel
Orange ansprechen. Dies trifft auch für Neurone in den sekundären
Kortexarealen
V2 und V3 zu.
Auch für das sich
an V1 anschließende visuelle Areal V2 wurde bisher davon ausgegangen,
dass die
Farbinformation vorwiegend in ganz bestimmten streifenförmigen
Bereichen, den
sogenannten „dünnen Streifen“, verarbeitet wird, während sich die
Verarbeitung
von Bewegungsinformationen vor allem auf die „dicken Streifen“ und von
Forminformationen auf die „blassen Streifen“ konzentriert. Neuere
Ergebnisse
physiologischer und psychophysischer Untersuchungen zeigen, dass
Neurone in V2
nicht nur auf eines der Reizattribute wie Farbe, Form und Bewegung
ansprechen und
farbsensitive Neurone in V2 nicht nur auf die dünnen Streifen
beschränkt sind (Gegenfurtner, Kiper & Fenstemaker,
1996). Das bedeutet, dass visuelle
Reizattribute kombiniert verarbeitet werden und daher keine strikte
Aufteilung
der visuellen Information in parallele Verarbeitungsbahnen vorliegt.
Psychophysisch ist inzwischen eindeutig belegt worden, dass Form und
Bewegung
auch bei Reizen wahrgenommen werden kann, die ausschließlich durch
Farbe
definiert (isoluminant) sind (Gegenfurtner
& Hawken, 1996).
Die von V1 und
V2 ausgehenden Projektionen in Richtung höherer Areale formen
einerseits den
dorsalen Pfad über Area MT zum
Scheitellappen oder Parietalkortex,
andererseits den ventralen Pfad über Area
V4 zum Inferotemporallappen.
Lange Zeit wurde die im temporalen Kortex gelegene Area
V4 zum kortikalen Farbzentrum erklärt, da hier die Mehrzahl der Neurone
selektiv auf Reize verschiedener Wellenlänge und Farbe antworten (Zeki, 1980). Darüber hinaus zeigen die meisten
V4-Neurone
ähnlich wie in V2 eine Selektivität für die Form von Reizen, zum
Beispiel für
ihre Länge, Breite, Orientierung und Größe (Desimone
& Schein, 1987). Da aber V4-Neurone auch selektiv auf die
Bewegungsrichtung
und Geschwindigkeit eines Reizes reagieren und ihr Antwortverhalten
durch
Aufmerksamkeitsprozesse (Moran & Desimone, 1985) beeinflusst werden kann,
scheinen in diesem
Hirnareal eher vielfältige Verarbeitungsprozesse, die vermutlich eine
wichtige
Vorstufe zur Objekterkennung und Handlungssteuerung darstellen als
spezielle
Farbanalysen wie z. B. Farbkonstanzbewertungen abzulaufen. Die Neurone
der
angrenzenden temporalen Bereiche am „Ende“ der ventralen Bahn zeigen
jedenfalls
eine erstaunliche Selektivität für komplexe Formen und Muster.
Objekterkennung
Im temporalen
Kortex konnten Bereiche identifiziert werden, die spezifisch auf ganz
bestimmte
Objektkategorien antworten. Untersuchungen an Affen und Menschen
zeigten, dass
einige Zellen des inferotemporalen Kortex
nur auf
Hände oder Gesichter ansprechen. Unter den gesichtsspezifischen Zellen
gibt es
solche, die besonders gut auf frontale Ansichten von Gesichtern
ansprechen.
Verändert man das Gesicht, indem man Teile weglässt oder im Profil
zeigt,
verringern die Neurone ihre Antwort (Bruce, Desimone
& Gross, 1981). Andere reagieren
bevorzugt auf
Profilansichten, bestimmte Gesichtsausdrücke oder nur einzelne
Gesichtselemente. Zum Teil
genügen schon Grundelemente wie zwei Punkte und ein Strich um eine
Reaktion
auszulösen (Kobatake & Tanaka, 1994).
Es scheint
eine Aufteilung in Neuronenpopulationen zum Erkennen allgemeiner
Eigenschaften
von Gesichtern und solchen zum Erkennen individueller Gesichter zu
existieren.
An der Erkennung eines Gesichtes sind Verbände von Neuronen mit
unterschiedlichen Antworteigenschaften beteiligt. Die Identifizierung
eines
individuellen Gesichtes geschieht vermutlich aufgrund der spezifischen
Aktivitätsmuster solcher Neuronenverbände. Es existiert also kein
einzelnes
„Großmutterneuron“, das speziell für die Erkennung des Gesichtes der
Großmutter
zuständig wäre – allerdings sind nur wenige Neurone notwendig um ein
Gesicht
eindeutig zu erkennen. Im temporalen
Kortex des Menschen scheinen auch für die Repräsentation und Erkennung
anderer
Objektkategorien solche mehr oder weniger spezialisierten Bereiche zu
existieren (Kreiman, Koch & Fried,
2000).
Verarbeitungsgeschwindigkeit
Es ist bereits
rätselhaft, wie Neurone im Temporallappen solch komplexe
Antworteigenschaften
besitzen können. Wenn man sich allerdings vor Augen hält, dass diese
Neurone
nur 5-10 Schaltstationen nach der primären Sehrinde sitzen, dann wird
dieser
Prozess noch rätselhafter. Neurone in V1 zeigen eine hohe
Empfindlichkeit für
die Orientierung und Länge von Kantensegmenten, also für Bestandteile
von
Objekten. Diese Neurone müssen dann so verschaltet werden, dass ganze
Objekte
erkannt werden können, und zwar mit nur ganz wenigen
Verschaltungsstufen. Dies
wurde eindrucksvoll von Simon Thorpe und seinen Kollegen (Thorpe, Fize & Marlot,
1996)
nachgewiesen. Sie zeigten ihren Probanden Bilder von natürlichen
Szenen, in
denen ein Tier enthalten sein konnte. Aufgabe der Probanden war, eine
Reaktionstaste gedrückt zu halten und nur dann loszulassen, wenn ein
Bild mit
einem Tier gezeigt wurde. Nach der Darbietung eines Tierbildes dauerte
es in
der Regel 300 Millisekunden, bis die Taste losgelassen wurde. Dies
beinhaltet
jedoch auch die Zeit bis der visuelle Reiz überhaupt im Gehirn
angelangt ist,
und die Zeit zur Auslösung der motorischen Reaktion. Um einen besseren
Eindruck
von den Verarbeitungsprozessen im Gehirn zu erhalten, maßen Thorpe und
Kollegen
die Hirnströme der Probanden mittels des Elektroenzephalogramms (EEG).
Im EEG
zeigte sich dann, dass bereits nach 150 Millisekunden Unterschiede
zwischen den
Gehirnströmen in beiden Arten von Bildern bestanden. Das bedeutet, dass
das
Gehirn bereits nach 150 Millisekunden festgestellt hat, ob in dem Bild
ein Tier
enthalten ist. Da es ca. 50-80 Millisekunden dauert, bis der visuelle
Reiz
überhaupt in der primären Sehrinde angelangt ist, bleiben somit nur
noch 70-100
Millisekunden an kortikaler Verarbeitung für diese doch sehr komplexe
Aufgabe.
Das entspricht in etwa 5-10 kortikalen Verarbeitungsschritten.
Verarbeitung von Bewegung
Über die
Verarbeitung der Bewegungsinformation herrscht größere Einstimmigkeit
als über
diejenige der Farbinformation, auch wenn zum Beispiel die Frage, wie
die
Richtungsselektivität der Neurone in V1 und V2 entsteht, noch
weitgehend
ungeklärt ist (Ferster & Miller, 2000).
Einzelzellableitungen, Mikrostimulation und Läsionsexperimente
machen deutlich, dass für die Bewegungswahrnehmung das mediotemporale
Areal (MT oder V5) und sich daran anschließende Areale MST im parietalen Kortex eine ganz zentrale Bedeutung
besitzen.
Über 80% der Neurone in MT antworten selektiv auf eine bestimmte
Bewegungsrichtung
eines Reizes. Eine Zerstörung von MT verschlechtert kurzfristig die
Fähigkeit
Bewegungsrichtungen zu unterscheiden und bewegten Reizen mit den Augen
kontinuierlich zu folgen. An Affen konnte gezeigt werden, dass
elektrische
Reizungen von Neuronen in Area MT während
eines
Verhaltenstests die Wahrnehmung der Bewegungsrichtung von Testmustern
verändert
(Salzman & Newsome,
1990). Damit konnte zum ersten Mal direkt nachgewiesen werden, dass
diese
Areale an der Wahrnehmung von Bewegung beteiligt sind.
Visuelles Gedächtnis
Bisher haben wir
uns mit dem Aufbau eines inneren Bildes bei der Betrachtung visueller
Reize
beschäftigt. Die Wahrnehmungsinhalte gehen aber nicht sofort verloren,
sobald
die Wahrnehmung eines bestimmten Bildes beendet ist, sondern verbleiben
für
kürzere oder längere Zeit im visuellen Gedächtnis. Diese visuellen
Erinnerungen
können für Wahrnehmungsprozesse und die Verhaltenssteuerung genutzt
werden.
Das visuelle
Gedächtnis besteht aus mehreren Gedächtnissystemen mit
unterschiedlichen
Eigenschaften und lässt sich in drei Hauptkomponenten gliedern (Palmer,
1999).
Im Ikonischen Gedächtnis können für sehr begrenzte Zeit (im allgemeinen
kürzer als eine Sekunde) relativ große Informationsmengen gespeichert
werden,
die jedoch sehr schnell verblassen oder durch nachfolgende
Informationen
verdrängt werden. Im visuellen Kurzzeitgedächtnis werden Informationen
für
Minutenbruchteile gespeichert. Dauerhafter wird die Information im
visuellen
Langzeitgedächtnis niedergelegt, wo sie zum Teil noch nach Jahren
abgerufen
werden kann. Hier befinden sich unter anderem visuelle
Repräsentationen, die
wir benutzen um wahrgenommene Objekte zu kategorisieren. Der Einsatz
der
Gedächtnissysteme erfolgt entsprechend der jeweiligen Situation.
In einem
Experiment von Mary Hayhoe et al. (1998)
sollten die
Versuchspersonen ein vorgegebenes Muster aus verschiedenfarbigen,
rechteckigen
Flächen nachbauen. Im linken oberen Bereich eines Computermonitors
befand sich
die nachzubauende Vorlage, rechts daneben ein Feld mit verschiedenen
„Bausteinen“, die mit Hilfe der Maus bewegt werden konnten. Im linken
unteren
Bereich sollte die Vorlage rekonstruiert werden. Während des
Bauvorgangs wurden
die Augenbewegungen registriert. Typischerweise blickte die
Versuchsperson
zuerst von der „Baustelle“ zur Vorlage und von dort zum
„Materiallager“,
während sich die Maus zu den Bausteinen bewegte. Dann blickte sie
nochmals
zurück auf die Vorlage und anschließend auf die Stelle, wo sie den
neuen
Baustein einfügte. Die Versuchspersonen speicherten das Bild der
Vorlage also
nicht längerfristig im visuellen Gedächtnis, um es dauerhaft präsent zu
haben,
sondern sie benutzten Augenbewegungen und das Kurzzeitgedächtnis. Durch
den
ständigen Vergleich kann auf den aufwändigen Aufbau von
Langzeitinformation verzichtet
und schneller auf Veränderungen reagiert werden.
Ein großer Teil
der zur Orientierung in der Umwelt notwendigen visuellen Information
muss also
nicht über längere Zeit im Gehirn abgespeichert werden. Die Umwelt
selbst kann
hier als der „Bildspeicher“ dienen, auf den je nach Bedarf zugegriffen
werden
kann. Die Zeiträume zwischen diesen Zugriffen können wir mit Hilfe
unseres
visuellen Kurzzeitgedächtnisses überbrücken. Um uns in unserer Umwelt
orientieren zu können, müssen wir allerdings das wahrgenommene auch in
bestimmte Objektkategorien einordnen können. Die im visuellen
Langzeitgedächtnis gespeicherte Information versetzt uns in die Lage,
bekannte
Objekte schnell zu identifizieren.
Betreten wir
einen uns bekannten Raum, so haben wir in kürzester Zeit den Eindruck
ihn
vollständig erfasst zu haben. Das visuelle Gedächtnis hilft uns, schon
aus
wenigen Sinnesdaten eine vollständige Gestalt zu rekonstruieren, indem
die
Lücken mit schon gespeicherten Inhalten aufgefüllt werden. Die
Rekonstruktion
des Gesamtbildes aus wenigen Eckdaten kann jedoch auch zu
Fehlleistungen
führen. So kann es beispielsweise geschehen dass selbst größere
Veränderungen
in einer Gesamtszene nicht oder erst nach längerer, genauer Analyse
wahrgenommen werden. Dieses Phänomen wird als „change
blindness“ bezeichnet.
Das
rekonstruierte Bild der Umwelt beruht zu einem großen Teil auf Annahmen
über
die Beschaffenheit dieser Umwelt. Nur ein bestimmter Ausschnitt dieser
Umwelt
ist tatsächlich in unserem visuellen System repräsentiert.
Aufmerksamkeit
Experimente zur
visuellen Aufmerksamkeit liefern weitere Beweise dafür, dass unsere
Repräsentation der visuellen Umwelt vielleicht gar nicht so umfassend
und
naturgetreu ist wie es uns den Eindruck macht.
Um etwas in
unserer Umgebung genau wahrzunehmen, müssen wir uns darauf
konzentrieren. Die
Aufmerksamkeit, die nötig ist um detaillierte Informationen zu
erfassen, ist
jedoch eine streng begrenzte Ressource. Das „spotlight
of attention“ kann nur selektiv auf
bestimmte
Bereiche gerichtet werden. Wir erkennen nur die Dinge, auf die unser
Blick
gerade fällt. Aber auch wenn unsere Augen auf einen bestimmten Punkt
fixiert
sind, verarbeitet das visuelle System nicht einfach alle in diesem Bild
zur
Verfügung stehenden Informationen. Vielmehr kann die Aufmerksamkeit zu
unterschiedlichen Zeitpunkten auf unterschiedliche Aspekte desselben
Bildes
gerichtet werden. Wir können unsere Aufmerksamkeit entweder global auf
die
gesamte Szene verteilen oder auf die Wahrnehmung bestimmter Objekte
oder
Objekteigenschaften beschränken. Bei Konzentration auf bestimmte
Aspekte einer
Szene werden ansonsten sehr auffällige Veränderungen in der Szene zum
Teil
überhaupt nicht bemerkt („attentional blindness“). Simons & Chabris
(1999) zeigten Versuchspersonen einen kurzen Film, in dem zwei, durch
ihre
unterschiedliche Kleidung gekennzeichnete Teams von Basketballspielern
gleichzeitig mit je einem Ball spielten. Die Versuchspersonen wurden
aufgefordert, zu zählen, wie oft sich die Spieler eines der Teams den
Ball
zuspielten. Nach ca. 45 Sekunden tritt ein sogenanntes unerwartetes
Ereignis
ein: Eine Person im schwarzen Gorilla-Kostüm bewegt sich quer durch die
gesamte
Szene. Als die Versuchspersonen anschließend befragt wurden, ob ihnen
etwas besonderes aufgefallen wäre, konnte
ein großer Teil nicht
davon berichten, den „Gorilla“ gesehen zu haben. Durch die
Konzentration auf
das Ballspiel war der Auftritt des „Gorillas“ nicht bemerkt worden.
Die Steuerung von
Aufmerksamkeitsprozessen geschieht über Feedback-Verbindungen.
Informationen,
welche Bestimmte Aspekte oder Bereiche einer wahrgenommenen Szene
betreffen,
können über top-down-Prozesse selektiv
verstärkt
werden, während andere Informationen ausgefiltert werden (Kandel
& Wurtz, 2000).
Vorstellung
Unsere
Aufmerksamkeit können wir nicht nur auf die Wahrnehmung der uns
umgebenden Welt
richten. Wir sind in der Lage, uns auch Dinge, die wir nicht sehen,
bildlich
vorzustellen und mit Hilfe eines „geistigen Auges“ zu betrachten. Aus
dem
Gedächtnis können Bilder von Objekten abgerufen und visualisiert
werden. Diese
vorgestellten Bilder sind allerdings meist undeutlicher und weniger
detailliert
als die Wahrnehmung.
Vermutlich liegt
bildlichen Vorstellungen eine sog. top-down-Aktivierung
visueller Hirnareale zugrunde. Das heißt der Informationsfluss verläuft
bei
bildhafter Vorstellung umgekehrt zur normalen visuellen Wahrnehmung.
Zumindest ein
Teil unserer visuellen kortikalen Areale wird sowohl für die bildhafte
Vorstellung als auch für die normale visuelle Wahrnehmung genutzt. In
beiden
Fällen erfüllen diese Areale bezüglich spezifischer Informationen über
zum
Beispiel Farbe, Form, räumliche Orientierung usw. dieselben repräsentationalen
Funktionen. Einige der in die Erzeugung mentaler Bilder involvierten
Areale
sind anscheinend räumlich-kartographisch organisiert. Das bedeutet,
dass hier
einzelne Bildpunkte entsprechend ihrer verhältnismäßigen Entfernung
zueinander
abgebildet bzw. repräsentiert werden (Farah, 2000).
Auf eine mehr
bildähnliche, räumliche (analoge) Natur der Repräsentation, im
Unterschied zu
einer eher sprachähnlichen (propositionalen)
weisen
auch Experimente von Kosslyn (1995) hin.
Die
Versuchspersonen mussten sich das Bild eines Objekts, zum Beispiel
eines Bootes
oder einer Insel, einprägen und anschließend bildlich vorstellen. Dann
sollte
die Versuchsperson einen bestimmten Teil des vorgestellten Objekts
fokussieren,
woraufhin sie aufgefordert wurde, einen anderen Teil des imaginierten
Objekts
im mentalen Bild zu suchen. Die Dauer der Suche benötigt umso mehr
Zeit, je
weiter das gesuchte Objekt vom Ausgangspunkt der Suche entfernt ist. In
anderen
Versuchen wurden Personen aufgefordert, sich einen Gegenstand, einen
Buchstaben
oder ein Tier, einmal groß und einmal klein, beziehungsweise in
geringer und
großer Entfernung vorzustellen. Die Hirnaktivität in den topographisch
organisierten Arealen des okzipitalen
visuellen
Kortex während der Visualisierung entspricht derjenigen während des
Betrachtens
realer Objekte entsprechender Größe. Bei einer Patientin, der ein Teil
des okzipitalen Kortex entfernt werden
musste, zeigte sich eine
Verringerung der maximal visualisierbaren Größe eines bestimmten
Gegenstandes
in verhältnismäßiger Übereinstimmung mit der Verringerung der
kortikalen Areale
(Farah, Soso & Dasheiff, 1992).
Auf die Existenz
spezifischer Mechanismen zur Erzeugung mentaler Bilder weisen
Untersuchungen an
hirngeschädigten Patienten hin, die eine Trennung von Wahrnehmung und
Vorstellung sowie eine Lokalisation im linken tempero-okzipitalen
Bereich zeigen (Farah, 2000).
Nach einem Modell
von Kosslyn könnten aus – im visuellen
Langzeitgedächtnis in analoger und propositionaler
Form gespeicherten – Repräsentationen, in einem visuellen Puffer
(eventuell
identisch mit dem visuellen Kurzzeitgedächtnis) bildhafte Vorstellungen
als analoge
Kurzzeitrepräsentationen generiert werden. Die Bildverarbeitung könnte
mit
Hilfe von ebenfalls im Langzeitgedächtnis abgespeicherten
Routineoperationen
durchgeführt werden (Palmer, 1999; Kosslyn
&
Thompson, 2000).
Fazit
Visuelle
Information wird von lichtempfindlichen Rezeptoren im Auge in
Nervenimpulse
umgewandelt. Diese werden in das Gehirn weitergeleitet und dort zu
Sinnesempfindungen interpretiert. Die Repräsentation dieser Reize im
Gehirn ist
sehr effizient und auf die Art der Umgebungsreize optimal abgestimmt.
Die
visuelle Verarbeitung dient in erster Linie dazu, unsere Interaktionen
mit der
Umwelt zu steuern.
Literatur
Bonhoeffer, T. & Grinvald, A.
(1991):
Iso-orientation domains in cat visual Cortex are arranged in
pinwheel-like
patterns. Nature 353 (6343),
429-31.
Bruce C., Desimone,
R. & Gross, C.G. (1981) Visual properties of neurons in a
polysensory area
in superior temporal sulcus of the macaque. Journal of
Neurophysiology. 46, 369-384.
Derrington, A.M., Krauskopf,
J. & Lennie, P. (1984) Chromatic
mechanisms in lateral geniculate nucleus of macaque. Journal
of Physiology. 357, 241-265.
Desimone, R.
& Schein,
S.J. (1987)Visual properties of neurons in area V4 of the macaque:
sensitivity
to stimulus form. Journal of
Neurophysiology. 57, 835-868.
Farah, M. J.; Soso, M. J. &
Dasheiff, R. M.
(1992): The visual angle of the mind’s eye before and after unilateral
occipital lobectomy. J. Exp. Psych.: Human Percept. Perform. 18,
241-246.
Farah, M. J. (2000): The Neural Basis
of Mental
Imagery. In: Gazzaniga, M. S.: The New Cognitive Neurosciences.
Ferster, D. & Miller, K. D.
(2000): Neural
mechanisms of orientation selectivity in the visual Cortex. Ann. Rev. Neurosci. 23, 441-471.
Gegenfurtner, K. R. & Hawken, M. H. (1996) Interaction of motion and color in the visual pathways. Trends in Neurosciences, 19, 394-401.
Gegenfurtner, K. R.; Kiper, D. C. & Fenstemaker, S. B. (1996): Processing of color, form, and motion in macaque area V 2. Vis. Neurosci. 13 (1), 161-172.
Goodale, M. A. & Milner, A. D. (1992): Separate visual pathways for perception and action. Trends Neurosci 15 (1), 20-25.
Hayhoe, M. M.; Bensinger, D. G., Ballard, D. H. (1998): Task Constraints in Visual Working Memory. Vision Research 38 (1), 125-137.
Hubel, D. H.; Wiesel T. N. (1959): Receptive fields of single neurons in the cat`s striate Cortex. J. Physiol. (Lond.) 148, 574-591.
Kandel, E. R. & Wurtz, R. H.
(2000):
Constructing the Visual Image. In: Kandel, E. R.; Schwartz, J. H. &
Jessell, T. M. (Hg.): Principles of Neural Science.
Kobatake, E. & Tanaka, K. (1994): Neuronal selectivities to complex object features in the ventral visual pathway of the macaque cerebral cortex. J. Neurophys. 71, 856-867.
Kosslyn, S. M. (1995): Mental
Imagery. In: Kosslyn, S. M. & Osherson, D.
N. (Hg.):
Visual Cognition. An Invitation to Cognitive
Science.
Kosslyn, S. E. & Thompson, W. L.
(2000):
Shared Mechanisms in Visual Imagery and Visual Perception: Insights
from
Cognitive Neuroscience. In: : Gazzaniga, M. S.: The New Cognitive
Neurosciences.
Kreiman, G.; Koch, C. & Fried,
Livingstone, M.S. and Hubel, D.H. (1984) Anatomy and physiology of a color system in the primate visual cortex. Journal of Neuroscience, 4, 309-356.
Mishkin, M.; Ungerleider, L. G. & Macko, K. A. (1983): Object vision and spatial vision: Two central pathways. Trends in Neurosci. 6, 414-417.
Moran, J. & Desimone, R. (1985): Selective attention gates visual processing in the extrastriate cortex. Science 229, 782-784.
Palmer, S. E. (1999): Vision Science.
Photons to
Phenomenology.
Salzman, C.D., Britten, K.H. & Newsome, W.T.
(1990) Cortical microstimulation influences perceptual judgements of
motion
direction. Nature. 346, 174-177.
Schiller, P. H.; Logothetis, N. K. & Charles, E. R. (1990): Functions of the colour-opponent and broad-band channels of the visual system. Nature 343, 68-70.
Simons, D. J. & Chabris, C. F. (1999): Gorillas in our midst: sustained inattentional blindness for dynamic events. Perception 28 (9), 1059-1074.
Thorpe, S., Fize, D.,
Marlot, C. (1996) Speed of processing in the human
visual system. Nature. 381, 520-522.
Ungerleider, L. D. & Mishkin, M. (1982): Two cortical visual systems. In: Ingle, D. J.; Goodale, M. D. & Mansfield, R. J. (Hg.): Analysis of visual behavior. Cambrigde, MIT Press.
Wässle, H. Boycott,
B.B.
(1991) Functional architecture of the mammalian retina. Physiological
Reviews. 71, 447-80.
Zeki, S. (1980) The representation of
colours in
the cerebral cortex. Nature, 284, 412-418.